郑州源创基因科技有限公司成立于2016年,由哥伦比亚大学博士后赵辉,归国创办的国家高新技术企业。拥有97项知识产权及实用技术,业务遍布上海、重庆、深圳、北京等城市,总部在郑州航空港区。
随着我国人口老龄化日趋加重,骨质疏松症这类让骨骼变脆、容易骨折的“隐形杀手”,正逐渐成为影响中老年人健康的重要问题。人们普遍认为骨质疏松是因为“缺钙”,于是大量补钙、晒太阳、喝牛奶,然而效果却常常不能尽如人意。难道问题真的只是“钙”不够吗?
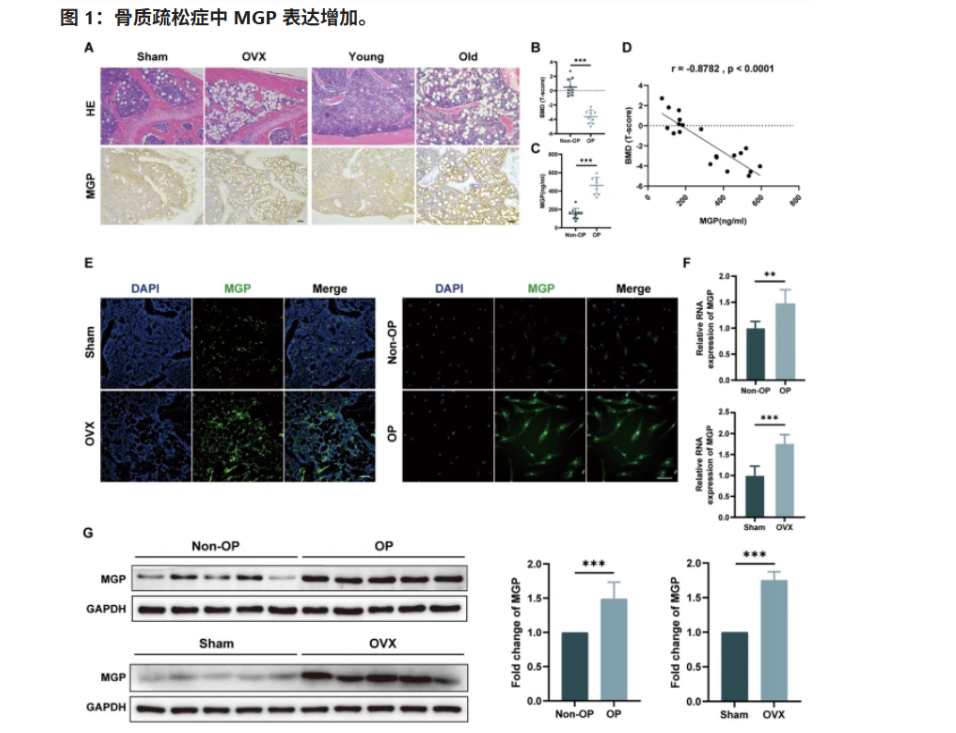
近日,中山大学附属第八医院的科研团队在国际期刊《Cell Death Discovery》上发表了一项重磅研究,首次从干细胞的角度揭示了骨质疏松的深层次机制。他们指出,骨髓中的干细胞失衡,才是导致骨质疏松的重要原因。

干细胞“走错路”,骨头变得越来越脆
我们的骨头并不是一成不变的,它其实每天都在“拆旧建新”。支撑这种循环更新的,是存在于骨髓中的一类“万能细胞”——骨髓间充质干细胞(BM-MSCs)。正常情况下,它们会分化为骨细胞,参与骨骼修复与重建。
但研究发现,在骨质疏松症患者体内,这些干细胞却偏离了原本的“职业路线”。它们不再安心“修建骨头”,反而更倾向于变成脂肪细胞,导致骨髓里脂肪越来越多,骨结构却越来越薄弱。
为了验证这一现象,研究团队特地招募了多名骨质疏松患者(OP)与同样人数的健康对照者(Non-OP),深入对比了两组人群的BM-MSCs分化行为,结果非常明确:骨质疏松人群的干细胞存在显著的“偏差”,更容易向脂肪方向发展。
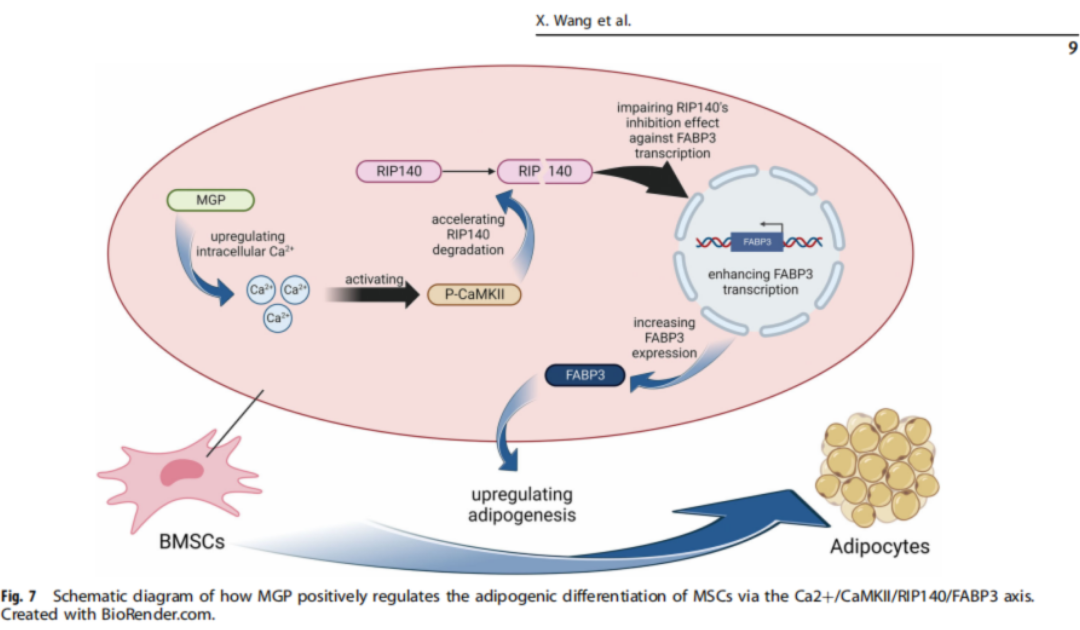
MGP蛋白:干细胞命运的“操盘手”
是什么在操控干细胞的“职业选择”?研究的重点落在了一种名叫MGP(基质Gla蛋白)的分子上。
研究发现,在骨质疏松人群中,MGP的表达水平显著升高。这个看似不起眼的小分子,其实在细胞内部起着关键作用。它能调节细胞内的钙离子浓度,一旦水平升高,就会触发一系列连锁反应,包括激活CaMKII信号通路,进一步促使一种名为RIP140的抑脂蛋白降解,最终让FABP3等脂肪生成相关基因被“放开手脚”。
通俗来说,MGP就像一个“指挥官”,它决定了干细胞是去“修骨”还是“长脂肪”。MGP过度活跃,就相当于在干细胞耳边大喊:“别修骨了,来造脂肪吧!”
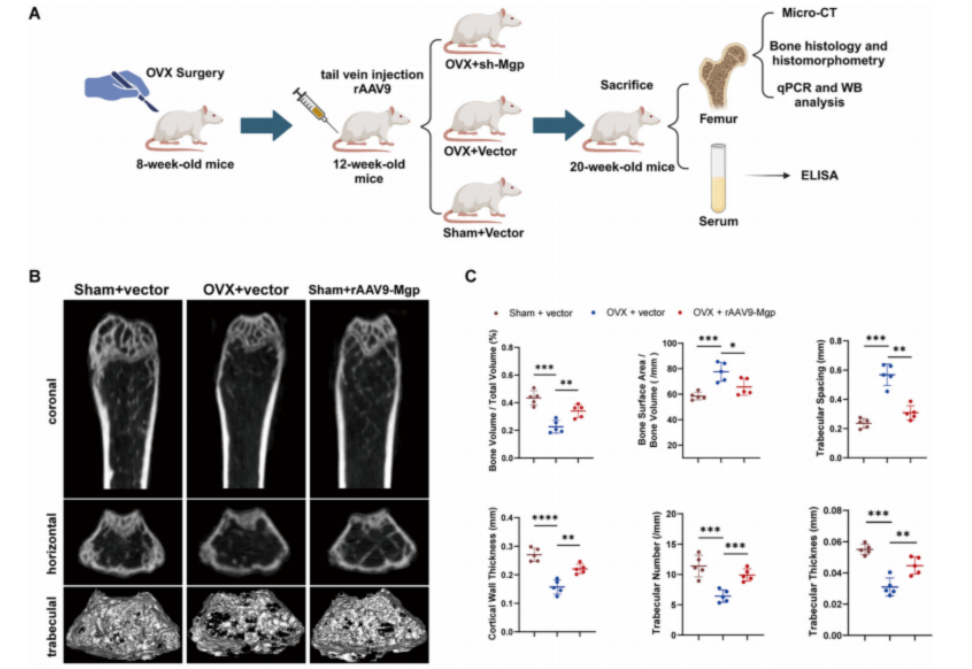
动物实验证实:调控MGP,骨骼变强了!
理论听起来不错,那实践效果如何?科研团队选择了骨质疏松动物模型进行实验证明。
他们使用一种基因操作工具——重组腺相关病毒rAAV9,成功抑制了实验小鼠体内的MGP表达。结果令人振奋:小鼠的骨密度显著提升,骨髓中脂肪细胞减少,骨组织结构也得到了明显改善。
这一成果表明,通过精准干预MGP等关键分子,或许能够扭转干细胞的分化方向,让它们重新回到“造骨”的轨道上,从根源改善骨质疏松!
展望未来:从实验室走向临床的关键一步
这项研究为骨质疏松的治疗打开了一扇新窗。传统方法多是“治标”——补钙、激素、抑制骨吸收等,但如果从干细胞“造骨能力”本身出发,精准干预分化过程,我们就有机会走向真正的“治本”。
当然,从动物实验到临床应用,还需经历安全性验证、药物开发、治疗路径优化等多个阶段。但可以预见,干细胞与细胞疗法将在未来医学中扮演越来越关键的角色。
总而言之,《Cell Death Discovery》上发表的这项研究,为骨质疏松症的治疗提供了全新的思路。未来,若能将这种基因干预技术与现有的治疗方法相结合,就有可能开发出副作用更小、疗效更持久的新药,为广大骨质疏松症患者重塑健康骨骼铺平道路。
【文献来源】Wang, X., Zhang, Y., Xu, C. et al. MGP regulates the adipogenic differentiation of mesenchymal stem cells in osteoporosis via the Ca2+/CaMKII/RIP140/FABP3 axis. Cell Death Discov. 11, 166 (2025). https://doi.org/10.1038/s41420-025-02472-2