郑州源创基因科技有限公司成立于2016年,由哥伦比亚大学博士后赵辉,归国创办的国家高新技术企业。拥有97项知识产权及实用技术,业务遍布上海、重庆、深圳、北京等城市,总部在郑州航空港区。
桥本甲状腺炎(Hashimoto’s Thyroiditis,HT),又称慢性淋巴细胞性甲状腺炎或自身免疫性甲状腺炎,是一种因免疫系统异常攻击甲状腺组织而导致的慢性炎症性疾病。该病约占甲状腺炎病例的80%,在我国患病率超过2%,女性发病率约为男性的10倍。其核心病理机制为自身免疫系统持续攻击甲状腺,导致甲状腺功能进行性减退。
病程各阶段临床表现:
沉默期:在疾病早期,免疫系统已开始攻击甲状腺,导致血清中抗甲状腺过氧化物酶抗体(TPOAb)和抗甲状腺球蛋白抗体(TgAb)升高,但患者通常无明显临床症状。
甲亢期:此阶段因甲状腺滤泡破坏导致甲状腺激素释放增多,出现血清三碘甲状腺原氨酸(T3)、甲状腺素(T4)水平升高,促甲状腺激素(TSH)水平降低,持续时间通常为1–6周。临床可表现为心悸、食欲亢进、乏力、多汗等症状,建议采取忌碘饮食。
亚临床甲减期:甲状腺激素分泌开始减少,血清TSH水平升高,但患者仍可能无明显症状。
甲减期:甲状腺滤泡严重受损,T3、T4水平下降,TSH升高,出现典型甲减症状,如疲劳、情绪低落、体重增加、便秘、皮肤干燥及畏寒等。
传统治疗以甲状腺激素替代为主,虽可缓解症状,但无法阻断自身免疫攻击或修复已损伤的甲状腺组织。
间充质干细胞:免疫调节与组织修复的双重机制
间充质干细胞(MSCs)具有低免疫原性、多向分化潜能及旁分泌功能,可通过以下机制干预桥本甲状腺炎的进程:
1.免疫调控:重建自身免疫平衡
u 抑制过度免疫反应
调节T细胞亚群平衡:MSCs通过分泌TGF-β、IL-10等抗炎因子,抑制促炎性Th17细胞分化,同时促进调节性T细胞(Treg)增殖,重建免疫耐受。
抑制B细胞活化:阻断B细胞异常增殖及TPOAb、TgAb等自身抗体产生,减轻对甲状腺滤泡的破坏。
调控巨噬细胞极化:促使促炎M1型向抗炎M2型转化,缓解甲状腺局部炎症。
u 多途径抗炎作用
分泌抗炎介质:MSCs释放前列腺素E2(PGE2)、吲哚胺2,3-双加氧酶(IDO)等分子,直接抑制自然杀伤(NK)细胞和树突状细胞的活化。
细胞接触依赖性调控:通过表面分子如PD-L1、HLA-G与免疫细胞直接作用,诱导免疫失能。
2.组织修复与再生:恢复甲状腺功能
定向分化为甲状腺细胞
在甲状腺微环境诱导下,MSCs可分化为甲状腺滤泡上皮细胞,补充受损组织。
旁分泌促进修复
释放营养因子:分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)等,促进血管新生与滤泡细胞增殖。
抗纤维化作用:通过降低TGF-β1信号通路活性,抑制甲状腺组织纤维化进程。
保护残余甲状腺细胞
通过减轻氧化应激与线粒体损伤,抑制甲状腺细胞凋亡,如下调Bax/caspase-3通路表达。
临床进展

一项发表于《Autoimmunity》的研究《Therapeutic effect of mesenchymal stem cell on Hashimoto's thyroiditis in a rat model by modulating Th17/Treg cell balance(干细胞通过调节Th17/Treg细胞平衡改善大鼠桥本甲状腺炎的治疗效果)》显示,研究人员利用雌性SD大鼠构建HT模型,评估MSCs对Th17/Treg平衡的调节作用:
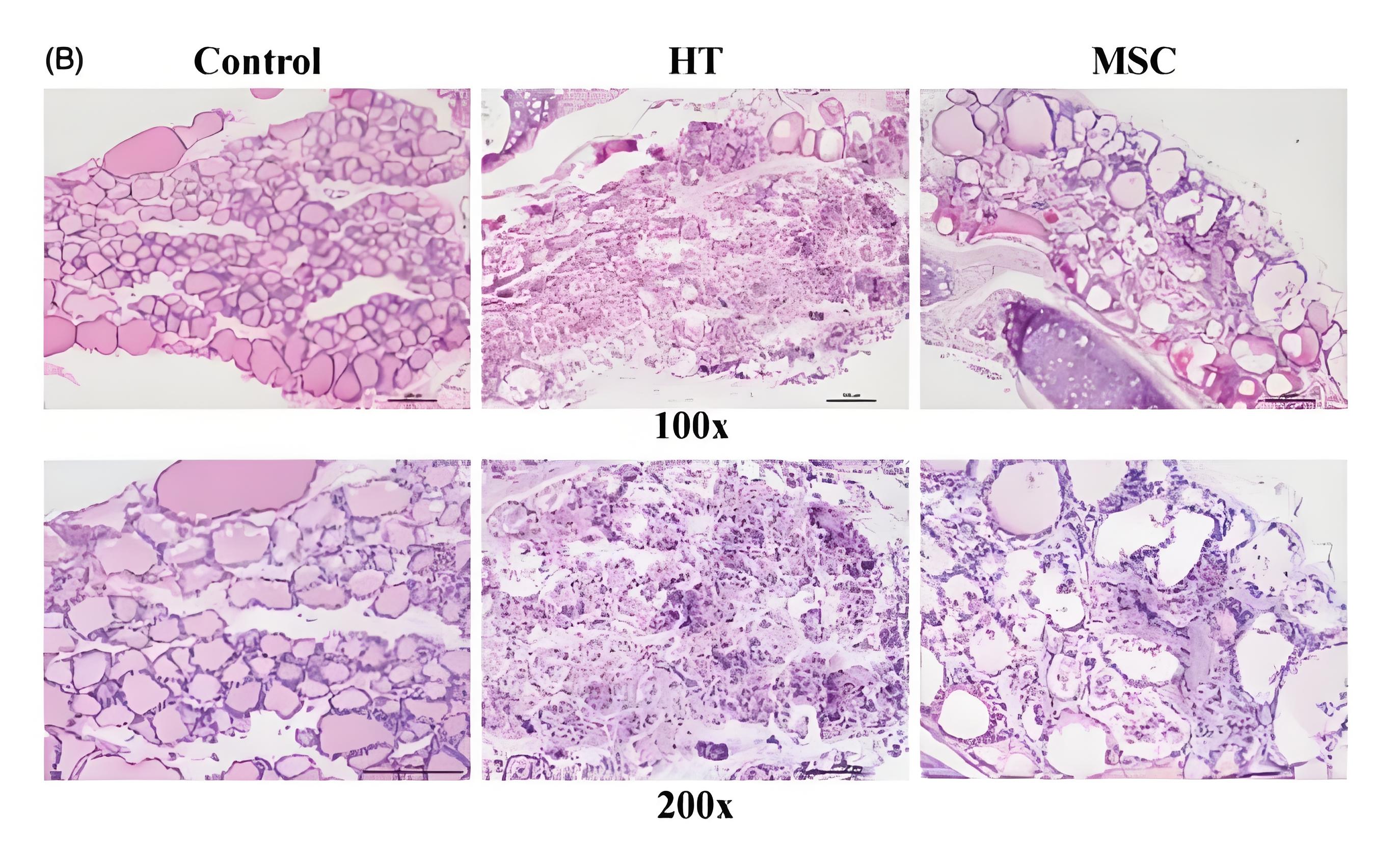
(1)MSCs治疗减轻甲状腺病理损伤
HT模型组甲状腺滤泡明显萎缩,MSCs治疗组甲状腺病变减轻,组织结构更为完整。
(2)血浆细胞因子与激素水平变化
HT模型组血清TgAb与TPOAb水平显著升高,MSCs治疗组自身抗体水平降低,同时血浆IL-6、TSH、FT3与FT4水平也显著下降。
(3)Th17与Treg细胞变化
与对照组相比,HT模型组Th17细胞频率升高,Treg细胞频率下降,FoxP3表达降低,RORγt表达升高。MSCs治疗组Treg细胞频率升高,Th17细胞频率下降,Treg/Th17比例升高,FoxP3表达上升,RORγt与Caspase-3表达下降。
(4)体外实验中MSCs对T细胞亚群的影响
MSCs可降低Th17细胞比例,提高Treg细胞比例,FoxP3表达上升,RORγt表达下降,提示MSCs在体外可调节CD4⁺T细胞亚群平衡。
MSCs能够降低HT模型鼠的自身抗体水平,减轻甲状腺组织损伤,通过调节Treg/Th17平衡抑制甲状腺细胞凋亡,并在体外实验中表现出对T细胞亚群的有效调控。
结语
间充质干细胞通过“免疫调节—组织修复”双重机制干预桥本甲状腺炎:在免疫层面重塑Th17/Treg平衡,抑制自身抗体产生;在组织层面促进甲状腺细胞分化与旁分泌修复,逆转纤维化与功能障碍。
尽管干细胞疗法前景广阔,其大规模临床应用仍需更多临床试验验证。随着再生医学与免疫工程技术的不断融合,未来十年有望实现桥本甲状腺炎治疗从“控制病程”到“逆转损伤”的转变。
内容来源:本正清源干细胞
https://mp.weixin.qq.com/s/j35sWivW1y-nUl0Hwwz9sg
https://www.tandfonline.com/doi/full/10.1080/08916934.2019.1697689